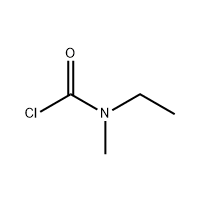
3'-Амино-2'-гидрокси-[1,1'-бифенил]-3-карбоновая кислота
3'-Амино-2'-гидрокси-[1,1'-бифенил]-3-карбоновая кислота
3'-Амино-2'-гидрокси-[1,1'-бифенил]-3-карбоновая кислота используется в качестве промежуточного соединения элтромбопага.
Элтромбопаг, разработанный GlaxoSmithKline (GSK) в Великобритании, а затем совместно с Novartis в Швейцарии, является первым и единственным в мире одобренным низкомолекулярным непептидным агонистом рецепторов ТПО.Элтромбопаг был одобрен FDA США в 2008 году для лечения идиопатической тромбоцитопенической пурпуры (ИТП) и в 2014 году для лечения тяжелой апластической анемии (АА).Это также первый за последние 30 лет препарат, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения АА.
В декабре 2012 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило элтромбопаг для лечения тромбоцитопении у пациентов с хроническим гепатитом С (ХГС), чтобы пациенты с гепатитом С с плохим прогнозом из-за низкого количества тромбоцитов могли начать и поддерживать стандартную терапию на основе интерферона для лечения заболеваний печени.3 февраля 2014 г. компания GlaxoSmithKline объявила о том, что FDA присвоило элтромбопагу прорывную квалификацию лекарственного средства для лечения гемопении у пациентов с тяжелой апластической анемией (SAA), которые не полностью ответили на иммунотерапию.24 августа 2015 г. FDA США одобрило элтромбопаг для лечения тромбоцитопении у взрослых и детей в возрасте 1 года и старше с хронической иммунной тромбоцитопенией (ИТП) при недостаточном ответе на кортикостероиды, иммуноглобулины или спленэктомию.4 января 2018 г. элтромбопаг был одобрен для включения в список в Китае для лечения первичной иммунной тромбоцитопении (ИТП).


![3'-Амино-2'-гидрокси-[1,1'-бифенил]-3-карбоновая кислота](http://cdn.globalso.com/jindunchem-med/image351.png)
![3'-Амино-2'-гидрокси-[1,1'-бифенил]-3-карбоновая кислота](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-тетра-О-актеил-1-С-[4-хлор-3-[[4-[[(3S)-тетрагидрофуран-3-ил]окси]фенил]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)